化學沉淀法處理高濃度化肥廠廢水
化學沉淀法是2O世紀9O年代興起的一種新的處理方法,尤其適合于高濃度氨氮廢水的處理,脫氮效率高,工藝簡單,可通過生成鳥糞石作為肥料回收氨。
MAP (Magnesium Ammonium Phosphate)化學沉淀法的基本原理是向含氨氮的廢水中添加鎂鹽和磷酸鹽,反應生成MAP (磷酸銨鎂)。產物的化學分子式是 MgNH4PO4·6H2O,俗稱鳥糞石。研究表明,MAP法可以有效地去除化肥廠廢水中的高氨氮。化學沉淀法為氮肥廢水高濃度氨氮的預處理問題提供了一種可行的途徑。
1 反應機理
向氨氮廢水中投加磷酸鹽和鎂鹽,發生的主要化學反應如下:
Mg2+ + PO43- + NH4+ + 6H2O= MgNH4PO4 · 6H2O (1)
Mg2+ + HPO42 - + NH4+ + 6H2O=MgNH4PO4 · 6H2O + H+(2)
Mg2+ + H2PO4- + NH4+ + 6H2O=MgNH4PO4 · 6H2O + 2H+(3)
Ks = [Mg2 +][NH4+][PO43 -] = 2.5 × 10- 13 (4)
由反應式(2)、(3)可知,試驗過程中水樣的 pH 值不斷下降,滴加 NaOH 溶液可促進(2)、(3)式向正反應方向進行。
2 結果和討論
MAP是堿性鹽,在堿性條件下溶解度隨pH值的升高而降低。當溶液pH值>9.5時,溶液中氨離子變成氣態氨揮發。同時,溶液中的Mg2+與OH-生成Mg(OH)2沉淀,當溶液pH值>11時,還將生成溶解度更低的Mg(PO4)3沉淀。當溶液pH值<7時,溶液中的PO43-濃度低,不利于反應(1)式的進行。因此,控制反應pH值在7.5~10之間,討論對氨氮去除率的影響。
2.2 藥劑配比對氨氮去除率的影響
由反應(1)式可知,生成MgNH4PO4·6H2O,理論上Mg2+:NH4+:PO43-的摩爾比應為1:1:1。根據同離子效應,增大Mg2+、PO43-的配比,可促進(1)式充分進行而提高氨氮的去除率。但經研究以及試驗表明,若NH4+:PO43-的摩爾配比<1,雖然在一定程度上提高了氨氮的去除率,但反應后的殘磷量卻高達幾百mg/L,帶來了新的污染。
因此,為確保效果并避免產生二次污染,根據反應動力學原理,在降低磷酸鹽投加比例的同時增加鎂鹽的投加量。首先固定Mg2+:NH4+的摩爾比為1.5:1,改變磷酸鹽的投加量,反應的pH值控制在9.0。
表 2 改變磷酸鹽投加比例對廢水氨氮去除率及殘磷量的影響
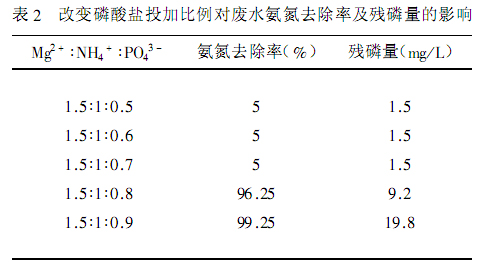 |
由表2知,當磷酸鹽配比為0.8和0.9時,氨氮的去除率分別為96.25%和99.25%,出水的氨氮濃度分別為75mg/L和15mg/L,殘磷量分別為9.2mg/L和19.8mg/L。固定PO43-:NH4+的摩爾比為0.9:1,改變鎂鹽的投加量,控制反應的pH值在9.0。研究改變鎂鹽的投加量對去除氨氮的影響。試驗結果如表3所示。
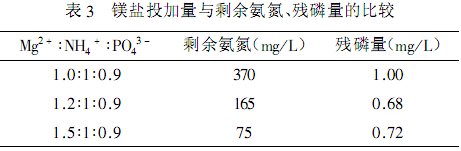 |
結果表明,增加鎂鹽的投加量,能有效地提高氨氮的去除率。當鎂鹽的投加比例為1.5時,廢水的氨氮濃度可以降到100mg/L以下。
3 沉淀物分析
由反應式以及試驗結果可知,反應產物的化學分子式為MgNH4PO4·6H2O,純晶體呈白色晶體粉末狀,比重是1.7,溶于酸,不溶于堿。MgNH4PO4·6H2O分子量為245,理論上每處理1kg氨氮,需要1.71kg鎂、2.21kg磷,以及一定量的NaOH溶液,同時可以生成17.5kgMAP 沉淀,由于磷酸氨鎂含有植物生長所需的N、P、Mg營養元素,且其養分比其他可溶肥的釋放速率慢,肥料利用率高,可作緩釋肥使用,不會出現灼燒情況。國外研究資料顯示,MAP的理論價格為198~330美元/噸,開發MAP作緩釋肥有較高的經濟價值,同時還可以降低高濃度氨氮廢水的處理費用。
4 結論
(1) 本文研究的是化肥廠氮肥廢水,氨氮濃度高達2000mg/L,用一般的生物法難以降解,且高濃度氨氮的廢水還會直接影響生物裝置的正常運行。化學沉淀法生成 MgNH4PO4·6H2O沉淀,廢水中氨氮的去除率高達95%以上,達到預處理目的,為后續生化處理奠定了基礎。
(2) 研究表明, 當采用 MgCl2·6H2O、Na3PO4·12H2O處理該廢水,Mg2+:NH4+:PO43-的摩爾比為1.5:1:0.9,pH值在9.0左右,原水中的氨氮濃度可由2000mg/L降到15mg/L,而殘磷量低于20 mg/L。
(3) 生成的磷酸氨鎂沉淀物溶解、釋放速度慢,農作物利用率高,對環境污染小,是一種很有價值的緩釋肥,肥料的開發利用可以大大降低廢水處理費用,具有較高的經濟價值。

使用微信“掃一掃”功能添加“谷騰環保網”








